pod patronatem Instytutu Medycyny Doświadczalnej i Klinicznej im. Mirosława Mossakowskiego Polskiej Akademii Nauk
Moderator: dr n. med. Anna Barczak
Uczestnicy: prof. Leonora Bużańska, prof. Bartosz Karaszewski, dr hab. Alina Kuryłowicz, prof. IMDiK PAN, dr hab. Anna Sarnowska, prof. IMDiK PAN


Wygłoszony przez prof. Leonorę Bużańską wykład pt. Modelowanie in vitro chorób neurodegeneracyjnych i neuronaczyniowych omawiał nowoczesne możliwości wykorzystania ludzkich indukowanych pluripotencjalnych komórek macierzystych (iPSC) otrzymanych dzięki reprogamowaniu dojrzałych komórek pacjentów z krwi lub fibroblastów skóry, bez interwencji w zarodek ludzki, tak więc w sposób niebudzący kontrowersji etycznych.
Komórki iPSC można różnicować we wszystkie typy komórek organizmu, w tym neurony, a następnie badać w hodowli 2D ich wzajemne interakcje (np. tworzenie sieci neuronalnych), a także ich wrażliwość na leki lub czynniki toksyczne. Model komórkowy 2D, choć dostarcza wielu ważnych informacji na temat molekularnych podstaw defektów rozwoju ośrodkowego układu nerwowego (OUN) lub chorób neurodegeneracyjnych, nie odzwierciedla jednak budowy i interakcji przestrzennych typowych dla tkanki lub organu. Dlatego zdolność komórek pluripotencjalnych do samoorganizowania się w trójwymiarowe struktury zwane organoidami okazała się nieocenionym przełomem w badaniach nad wczesnym rozwojem mózgu, których prowadzenie in vivo u człowieka jest niemożliwe. Badaczom udało się otrzymać w hodowli in vitro organoidy, które w trójwymiarze odzwierciedlają budowę struktur współtworzących mózg człowieka z pełną jego zwartością, architekturą i funkcjami (organoidy całego mózgu, ang. whole brain organoids).

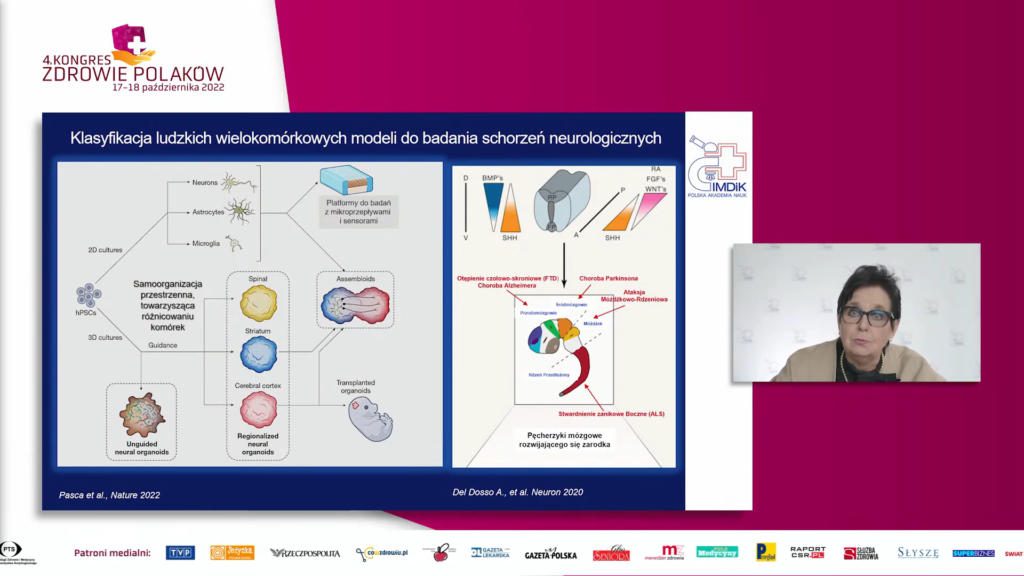
Stosując morfogeny wspomagające różnicowanie OUN, możliwe jest również otrzymywanie organoidów dla konkretnych części mózgu (ang. region specific brain organoids). Takie organoidy, typowe dla określonych regionów mózgu, można łączyć, tworząc „asemblody”, w których badane jest oddziaływanie między różnymi obszarami OUN i znaczenie tego oddziaływania w mechanizmach odpowiedzialnych za obserwowane patologie.
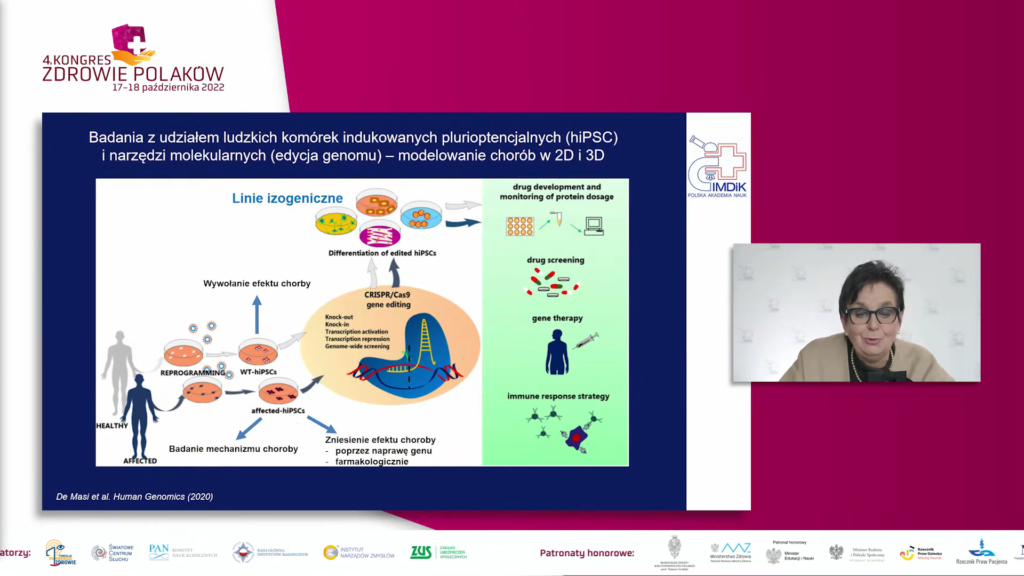
Organoidy mózgu otrzymane w hodowli z komórek pacjentów z ciężkimi schorzeniami neurologicznymi stanowią modele do badań tych chorób. Dodatkowo, nowoczesne narzędzia molekularne pozwalają na precyzyjne wprowadzenie zmian w genomie ludzkich „zdrowych” komórek iPSC, dzięki czemu możemy otrzymać tzw. linie komórkowe izogeniczne, które modelują genetycznie uwarunkowaną formę choroby neurodegeneracyjnej. Ponadto jeśli mamy do czynienia z chorobą genetycznie uwarunkowaną, dzięki możliwości edycji genomu komórek pacjenta może zostać przeprowadzana molekularna naprawa genomu i korekta tej zmiany. Organoidy mózgu wyprowadzone w hodowli in vitro z linii izogenicznych stanowią nieocenioną wartość dodaną do badań nad mechanizmami chorób neurorozwojowych, neurodegeneracyjnych i neuronaczyniowych. Możliwa jest również ocena wpływu farmakoterapii na chorobę poprzez dokładne ustalenie patomechanizmu choroby i mechanizmu działania badanej substancji farmakologicznej.
Badania z wykorzystaniem organoidów obejmują wiele chorób neurorozwojowych, np. autyzm, schizofrenię, mikrocefalię, a także neurodegeneracyjnych, jak choroba Alzheimera czy Parkinsona, oraz chorób nerwowo-mięśniowych, np. stwardnienie zanikowe boczne. Wprowadzanie naczyń krwionośnych do organoidów mózgu w hodowli in vitro oraz w modelach zwierzęcych in vivo stało się faktem, co umożliwia dalszą funkcjonalizację tych struktur i ma duże znaczenie dla poznania patomechanizmów schorzeń naczyniowych mózgu. Otrzymanie modeli określonych schorzeń neurologicznych z zastosowaniem organoidów mózgu jest bezsprzecznie krokiem milowym w zrozumieniu patomechanizmów tych chorób. Personalizacja badań z zastosowaniem organoidów mózgu będzie kluczowa dla określenia i dostosowania możliwych terapii chorób neurorozwojowych i neurodegeneracyjnych do potrzeb konkretnego pacjenta.
Mikrobiom
Dr hab. Alina Kuryłowicz, prof. IMDiK PAN, przedstawiła wykład: „Czy mikrobiom może wpływać na rozwój chorób neurodegeneracyjnych?”, który dotyczył mikroorganizmów znajdujących się w olbrzymiej liczbie w ciele człowieka i przetwarzających docierające do jelit substancje odżywcze.


Mikrobiom, poprzez udział np. w przemianie kwasów żółciowych czy aminokwasów, przyczynia się do zachowania homeostazy organizmu, ale w przypadku toksycznych substancji, może je przemienić w jeszcze bardziej szkodliwe dla organizmu produkty rozkładu. Mikrobiom reguluje funkcje wielu narządów, również mózgu, nie tylko poprzez metabolity, lecz także bezpośrednio – poprzez reakcje komórek neuroendokrynnych błony jelita oraz działanie immunomodulujące (poprzez produkcję cytokin, substancji prozapalnych). Prawidłowo działający mikrobiom uczestniczy w regulowaniu m.in. naszego stanu emocjonalnego, ale jego wadliwe działanie sprzyja powstaniu chorób neurodegeneracyjnych, np. choroby Alzheimera czy Parkinsona. Jest to spowodowane rozszczelnieniem bariery jelitowej i bariery „krew–mózg”. Toksyny przenikają poprzez nieszczelną barierę jelitową do układu krążenia, a stamtąd poprzez uszkodzoną barierę „krew–mózg” dostają się do ośrodkowego układu nerwowego. Naprawa szczelności bariery jelitowej wpływa na poprawę sprawności funkcji poznawczych. Odbywa się to poprzez suplementację probiotyków, prebiotyków lub kombinacji obu – symbiotyków. Mózg również wpływa na skład mikrobiomu i funkcjonowanie jelit poprzez aktywację osi „podwzgórze – przysadka – nadnercza” i produkcję kortyzolu, pobudzającego reakcje zapalne w jelitach. Modulując działanie i skład mikrobiomu, np. w przypadku udaru mózgu, powodującego wzrost produkcji kortyzolu, który z kolei pogarsza stan pacjenta poprzez właściwą suplementację, można przyspieszyć proces zdrowienia po incydencie naczyniowym.
Terapie eksperymentalne
Terapiom eksperymentalnym w neurologii (doniesienia naukowe 2021) poświęciła swoje wystąpienie dr hab. n. med. Anna Sarnowska, prof. IMDiK PAN. Największym zainteresowaniem w obszarze neurologii cieszą się obecnie terapie przeciwzapalne. W przypadku stwardnienia zanikowego bocznego większość leków oddziałuje na układ immunologiczny. Substancja o nazwie masitinib pozwala na przedłużenie życia pacjentów o 25 miesięcy pod warunkiem, że zostanie zastosowana we wczesnej fazie schorzenia.


Szybka diagnoza, będąca gwarantem skuteczności terapii, jest obecnie możliwa dzięki badaniom z zastosowaniem biomarkerów. Największa nadzieja jest pokładana w badaniu poziomu lekkich łańcuchów neurofilamentów z krwi obwodowej, a ich ocena również pozwala na monitorowanie zaawansowania choroby i pomaga w różnicowaniu innych chorób wynikających z uszkodzenia nerwów. Pozwala to nie tylko na szybsze rozpoznanie, lecz także lepszy dobór leków.
W stwardnieniu rozsianym stosowanie najnowocześniejszych leków przeciwzapalnych (evorutinib) skutkuje mniejszą liczbą zmian rzutowych obserwowanych w badaniu rezonansu magnetycznego. Przeciwciała przeciwamyloidowe (aducanumab i donemab) sprzyjają zmniejszeniu liczby złogów beta amyloidu w mózgu, ale tylko w grupie osób z bardzo wczesnymi etapami choroby Alzheimera, potencjalnie spowalniając postęp otępienia. Również terapie komórkowe poprzez łagodzenie stanu zapalnego są skuteczne w wielu chorobach neurologicznych. Innym nurtem badań jest zastosowanie najnowocześniejszych osiągnięć robotyki i technik komputerowych poprzez stymulowanie wszczepionymi do mózgu elektrodami niesprawnych kończyn pacjentów.
Udary
Choroby neuronaczyniowe – postęp terapeutyczny to temat poruszony podczas panelu przez prof. dr. hab. n. med. Bartosza Karaszewskiego. Udary mózgowe stanowią powszechny, poważny problem medyczny, a ze względu na często nieodwracalną niesprawność – również społeczny.

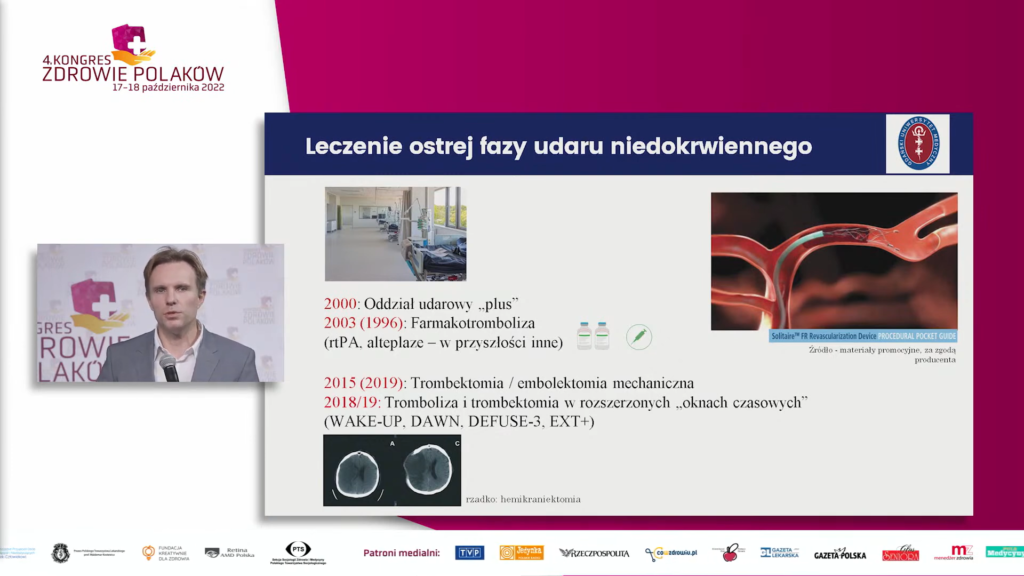
Leczenie ostrej fazy udaru niedokrwiennego odbywa się w rozbudowanym systemie obejmującym ratow¬nictwo medyczne, leczenie szpitalne z uwzględnieniem metod wczesnej interwencji farmakologicznej i mechanicznej (wewnątrznaczyniowej) oraz w dużej części specyficzne dla wczesnej fazy tej choroby postępowanie intensywistyczne i usprawniające, co łącznie skutkuje znacznym zwiększeniem szans na korzystne rokowanie. Jednym z zasadniczych kierunków rozwoju terapii udarów niedokrwiennych mózgu jest personalizacja kwalifikacji do terapii udrażniających naczynie na podstawie oceny tkankowej, to jest z jednej strony z uwzględnianiem wielkości już dokonanej martwicy, z drugiej – objętości tkanki objętej niedokrwieniem i innymi procesami patologicznymi wtórnymi do niedokrwienia, ale potencjalnie odwracalnymi, a nie tylko czasu od zamknięcia naczynia do interwencji. W algorytmach postępowania, tzw. przedłużonych oknach terapeutycznych, wiodącą rolę odgrywają określone techniki neuroobrazowe.
W rozwijaniu protokołów postępowania w udarach mózgu rozważa i bada się także rolę farmakoterapii adjuwantowej dla trombektomii mechanicznej, konstruowanie i zastosowanie nowych farmakotrombolityków, specjalne schematy u pacjentów wcześniej przyjmujących leki przeciwkrzepliwe, w dalszej zaś perspektywie także metody naprawcze, zarówno w rozumieniu strukturalnym, jak i funkcjonalnym, z uwzględnieniem stymulacji mechanizmów neuroplastyczności oraz wykorzystaniem wyników badań na organoidach.
Zważywszy na specyfikę choroby, szczególnie duże znaczenie w rokowaniach w medycynie udarów mózgu ma sprawność systemu ochrony zdrowia – logistyka postępowania we wczesnej fazie, która pomimo znaczących postępów, jakie dokonały się w Polsce w tej sferze w ostatniej dekadzie, wciąż wymaga określonych zmian.
Choroby neurozwyrodnieniowe
Diagnostyka przedkliniczna i prewencja chorób neurozwyrodnieniowych mózgu była tematem wystąpienia dr n. med. Anny Barczak. Choroby neurodegeneracyjne są grupą wrodzonych lub nabytych schorzeń układu nerwowego, a w ich przebiegu dochodzi do postępującego zaburzenia funkcji ruchowych i/lub poznawczych pacjenta, ograniczających jego samodzielne funkcjonowanie. W większości przypadków choroby neurodegeneracyjne mają ukryty początek, a faza przedkliniczna („nie ma”) w niektórych przypadkach może trwać nawet kilka dekad. Współczesne techniki diagnostyczne pozwalają na wykrycie niektórych chorób w okresie przedklinicznym. Niestety, większość z metod diagnostyki chorób neurodegeneracyjnych jest bardzo kosztowna, inwazyjna lub trudno dostępna.

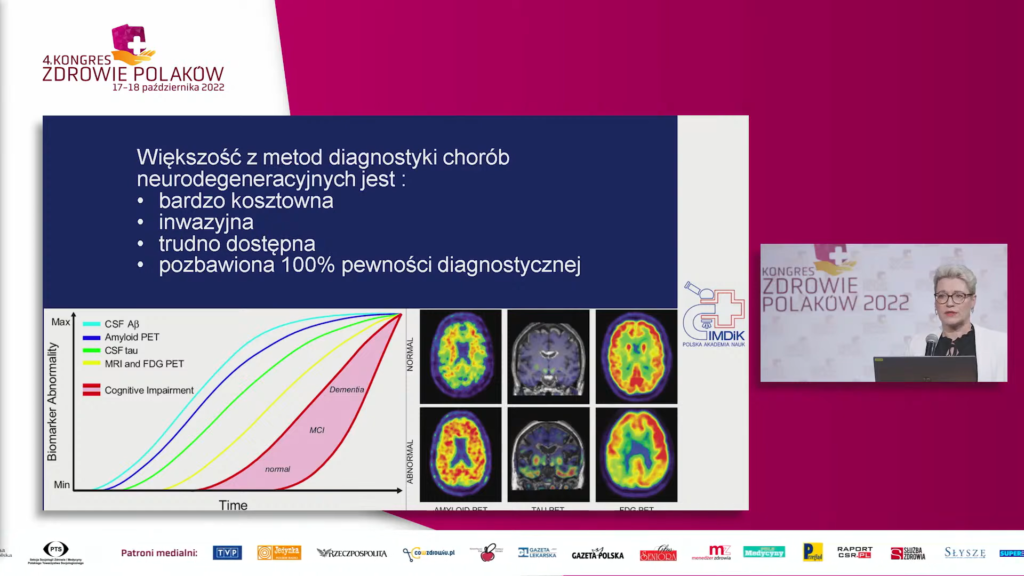
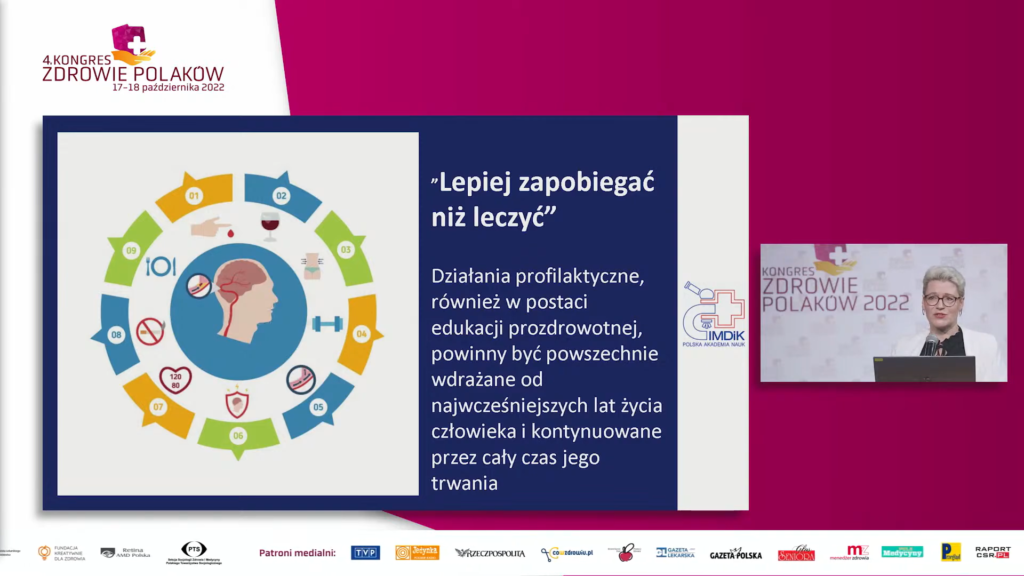
Wobec narastających problemów polskiej neurologii oraz coraz większej liczby pacjentów z chorobami mózgu profilaktyka chorób mózgu stanowi jeden z kluczowych elementów efektywnej ochrony zdrowia. W przypadku otępienia (fazy klinicznej chorób neurodegeneracyjnych) czynniki modyfikowalne odpowiadają za 40 proc. ryzyka rozwinięcia się schorzenia. W zależności od etapu życia inne czynniki mają kluczowe znaczenie. W młodym wieku jest to głównie poziom wykształcenia. Utrata słuchu, uszkodzenie mózgu, nadciśnienie tętnicze, nadużywanie alkoholu (powyżej 21 jednostek/tydzień) oraz otyłość są najważniejsze dla prewencji w wieku średnim, a u osób starszych są to: palenie tytoniu, depresja, izolacja społeczna, brak aktywności fizycznej, zatrucie środowiska (np. smog) oraz cukrzyca. Zgodnie z zasadą: „Lepiej zapobiegać, niż leczyć”, działania profilaktyczne, również w postaci edukacji prozdrowotnej, powinny być powszechnie wdrażane od najwcześniejszych lat życia człowieka i kontynuowane przez cały czas jego trwania.
Kończąca panel dyskusja z udziałem wykładowców, prowadzona przez dr Annę Barczak, skupiła się na przyszłości diagnozy i leczenia chorób neurodegeneracyjnych i neuronaczyniowych z uwzględnieniem roli profilaktyki, konieczności prowadzenia dalszych badań naukowych, które mogą być pomocne w poznaniu mechanizmów chorób mózgu i w poszukiwaniu skutecznych metod leczenia tych schorzeń.
Link do nagrania:
Dzień 2., kanał 5. – czas rozpoczęcia: 1:02:27

