Coraz więcej wiemy o ogromnej roli, jaką odrywa prawidłowy mikrobiom w fizjologii organizmu ludzkiego – największe znaczenie dla naszego zdrowia ma mikrobiota zasiedlająca jelita: nie tylko pomaga trawić pokarm i zaopatruje nas w niezbędne witaminy czy minerały, ale też reguluje pracę układu immunologicznego i chroni przed wieloma chorobami. Dla jej kształtowania zasadnicze znaczenie życie ma początek naszego życia: rozwój w łonie matki i 1000 kolejnych dni.
W ciągu ostatnich 20 lat znacznie poszerzyliśmy naszą widzę na temat mikroorganizmów (głównie bakterii) zasiedlających środowisko naturalne, w tym nasze własne organizmy. Do momentu wprowadzenia molekularnych technik identyfikacji (badanie materiału genetycznego bakterii) mogliśmy poznać tylko te gatunki, które udawało się wyhodować w laboratoriach (nieco ponad 1% wszystkich znanych obecnie). Znaliśmy głównie mikroby patogenne, wywołujące różne zakażenia, a nie zdawaliśmy sobie sprawy z istnienia niezwykłego bogactwa bakterii komensalnych i symbiotycznych, niezbędnych do prawidłowego przebiegu wielu procesów fizjologicznych w naszym ustroju, począwszy od okresu życia płodowego aż do śmierci.
Na kondycję mikroflory naszego ciała wpływa wiele czynników, przy czym najważniejszą rolę odgrywają te oddziałujące podczas życia płodowego i pierwszych trzech lat życia: sposób porodu, dieta oraz stosowanie antybiotyków. Zaburzenia mikroflory obserwowano podczas różnych schorzeń: zakażeń, alergii, chorób z autoagresji i zaburzeń metabolicznych. Dostrzeżenie tych zależności w ostatnich latach skłoniło badaczy do szukania możliwości takich modyfikacji składu bakteryjnego naszego organizmu by uzyskać korzystny efekt zdrowotny. Jest to możliwe po doustnym podaniu żywych bakterii (probiotyków) i/lub substancji stymulujących ich wzrost (prebiotyków). Dotychczasowe wyniki badań potwierdzają skuteczność oraz sugerują szerokie zastosowanie tych preparatów w profilaktyce i leczeniu różnych schorzeń, podkreślając jednocześnie ich bezpieczeństwo.
Mikrobiom człowieka
W międzynarodowym Projekcie Badania Mikrobiomu Ludzkiego (ang. Human Microbiome Project) w latach 2007-2013 scharakteryzowano populację wszystkich mikroorganizmów (komensalnych, symbiotycznych i patogennych) zasiedlających ciało ludzkie. Ta populacja, określana jako ludzki mikrobiom składa się z bakterii, grzybów (w tym drożdży), wirusów i bakteriofagów. Największą rolę przypisuje się tworzącym go bakteriom. Na powierzchni i wewnątrz naszego ciała żyje około 40 bilionów komórek bakteryjnych, a najbogatsza jest mikrobiota jelita grubego – tu zamieszkuje 99% wszystkich bakterii zasiedlających nasz organizm. Bogata jest także mikrobiota jamy ustnej i górnych dróg oddechowych, jelita cienkiego, skóry i dróg rodnych (Ryc. 1).
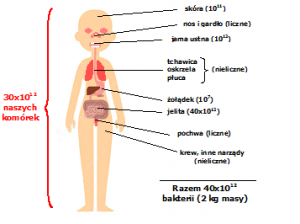
Mikrobiom ma ogromny wpływ na nasze zdrowie, reguluje metabolizm i różne procesy fizjologiczne, zapewnia właściwe działanie układu odpornościowego i przebieg procesów metabolicznych. Najważniejsza dla nas mikrobiota jelitowa uczestniczy m.in. w trawieniu i wchłanianiu substancji odżywczych, wytwarza niektóre witaminy, przyspiesza pasaż jelitowy (zapobiega wzdęciom i zaparciom), reguluje działanie układu odpornościowego, hamuje namnażanie patogennych drobnoustrojów i wzrost komórek nowotworowych.
Mikrobiom dorosłych, zdrowych ludzi ukształtowany podczas trzech pierwszych lat życia jest zasadniczo stały i charakterystyczny dla danej osoby. Mikrobiota jelitowa to ponad 500 gatunków bakterii, głównie należących do 4 typów: Firmicutes (tu należą bakterie z rodzaju Lactobacillus), Bacteroidetes, Proteobacteria oraz Actinobacteria (tu rodzaj Bifidobacterium). Zależy od środowiska i trybu życia (dieta, używki, zażywane leki, poziom higieny, stres). Zaobserwowano niewielkie i krótkotrwałe zmiany w obrębie mikrobioty jelitowej podczas stosowania znacznie zmienionej diety, np. bogatej w węglowodany roślinne po zwykłej diecie bogatej w tłuszcze zwierzęce. Znaczne zmiany w składzie mikrobioty jelitowej notowano natomiast po antybiotykoterapii – przyjmowanie antybiotyków może ją istotnie zubażać i zmieniać na długi czas (dni, miesiące, lata lub nawet trwale) w zależności od spektrum działania zastosowanych antybiotyków i czasu antybiotykoterapii.
Początkowy okres życia jest zatem zasadniczy dla rozwoju mikrobiomu. To, w jaki sposób przebiegnie kolonizacja organizmu dziecka przez drobnoustroje zadecyduje w dużym stopniu o jego dalszym życiu. Stała mikrobiota jelitowa kształtuje się już u płodu oraz podczas kolejnych 3 lat. Na jej rozwój wpływa kilka czynników: zdrowie matki w okresie ciąży i laktacji, sposób porodu, wiek ciążowy podczas porodu, sposób karmienia, przyjmowanie antybiotyków i inne medyczne interwencje oraz zróżnicowanie mikrobiologiczne środowiska życia dziecka.
Rodzaj porodu jako czynnik kształtujący mikrobiom
Istotnym czynnikiem kształtującym mikrobiotę jelitową dziecka jest sposób, w jaki przychodzi na świat. Nabrał on szczególnego znaczenia w ciągu ostatnich 20 lat, kiedy znacznie wzrosła liczba porodów drogą cesarskiego cięcia (CC). Pamiętając o niewątpliwych korzyściach CC, należy mieć na uwadze liczne ujemne strony tej interwencji, w tym jej niekorzystny wpływ na rozwój mikrobiomu nowo narodzonego dziecka.
Przejście przez pochwę zapewnia noworodkowi „kulturę starterową” drobnoustrojów, które jako pierwsze kolonizują jego organizm. Mikrobiota pochwy zmienia się podczas ciąży, z charakterystyczną przewagą bakterii z rodzaju Lactobacillus, które wytwarzając kwas mlekowy obniżają pH pochwy i chronią przed rozwojem patogenów.
Dziecko podczas porodu naturalnego nabywa mikrobiotę kolonizującą krocze matki, czyli typową dla pochwy i jelita. Urodzone przez CC jest kolonizowane głównie przez drobnoustroje zasiedlające skórę. Niektóre badania wykazały, że te różnice w składzie mikrobioty jelitowej mogą utrzymywać się przez długi czas.
Największe zmiany w mikrobiocie jelitowej obserwowano po elektywnym CC w porównaniu z CC przeprowadzonym już po rozpoczęciu porodu (wystąpienie skurczów macicy i przerwanie błon płodowych). Wskazuje to, że nie tylko przejście przez kanał rodny, ale cały proces porodu jest ważną determinantą przyszłego rozwoju mikrobioty. Należy pamiętać, że poród wywołuje duże zmiany hormonalne w ustroju zarówno matki, jak i dziecka, które przygotowują oboje do tego trudnego procesu. Reakcja stresowa u dziecka jest znacznie silniejsza niż obserwowana u osób dorosłych, o czym świadczy wyrzut katecholamin (adrenaliny i noradrenaliny) większy niż u pacjentów z zawałem serca czy guzem chromochłonnym. Ma ona przystosować dziecko do nowych warunków życia poza ustrojem matki. Stąd poród przez elektywne CC niesie ze sobą różnorodne powikłania, m.in. ze strony układu oddechowego, zaburzenia termogenezy i ciśnienia krwi, zmiany w metabolizmie glukozy i lipidów, opóźnione pierwsze karmienie, niedokrwistość oraz zmieniony fenotyp immunologiczny (mniejsza liczba i aktywność różnych komórek odpornościowych, niższe stężenia wielu cytokin w krążeniu, obniżenie systemu odporności wrodzonej). Można przypuszczać, że wszystkie te czynniki także wpływają na rozwój mikrobiomu dziecka urodzonego przez CC.
Dodatkowe znaczenie może mieć odmienny skład hormonalny oraz mikrobiologiczny mleka matek, które rodziły przez CC względem pokarmu kobiet rodzących siłami natury. Zarówno matka jak i dziecko w okresie poprzedzającym CC profilaktycznie otrzymują antybiotyki, co stanowi kolejny czynnik niekorzystnie kształtujący mikrobiotę dziecka.
Rozważając nabywanie mikrobioty przez dziecko podczas CC należy także mieć na uwadze dodatkowe elementy, które stanowią wskazania do tej procedury po stronie matki, a które już podczas życia prenatalnego mogą kształtować mikrobiotę dziecka. Są to: przedwczesny poród, znaczna otyłość, cukrzyca ciążowa, duże rozmiary dziecka, zakażenie matki.
Do niedawna uważano, że płód rozwija się w macicy w warunkach jałowych. Ostatnie odkrycia podważają jednak ten dogmat. Bakterie mogą trafiać do jelita płodu wraz z matczyną krwią pępowinową lub połknięte w płynie owodniowym. W tej sytuacji jest oczywiste, że prawidłowy skład mikrobioty jelitowej matki kształtuje prawidłową mikrobiotę jelita dziecka. Mikrobiota jelitowa kobiety zmienia się podczas ciąży z charakterystycznym wzrostem udziału bakterii z typów Proteobacteria i Actinobacteria w trzecim trymestrze, co indukuje fizjologiczną oporność na insulinę i sprzyja lepszemu zaopatrzeniu w energię i optymalnemu wzrostowi płodu. Na stan mikrobioty jelitowej ciężarnej i matki wpływają: dieta, zażywane leki (w tym sterydy i antybiotyki), długotrwały stres, otyłość, zakażenia przewodu pokarmowego.
Duży udział wśród dzieci urodzonych przez CC stanowią wcześniaki. U nich szczególnie niekorzystnie rozwija się mikrobiota jelitowa, ze względu na niedojrzały przewód pokarmowy i układ immunologiczny oraz: opóźnione żywienie doustne (często preparatami mlekozastępczymi), zastosowanie inwazyjnych procedur medycznych (w tym CC, antybiotyko- i sterydoterapii), długi pobyt na oddziale szpitalnym. Wszystkie te czynniki prowadzą do zaburzeń w składzie i liczbie bakterii jelitowych, nabywanych głównie ze środowiska szpitalnego: powietrza, od innych pacjentów i personelu medycznego. W wyniku nadmiernej odpowiedzi niedojrzałego układu immunologicznego jelita na bakterie i ich toksyny kilka procent wcześniaków, szczególnie z niską masą urodzeniową, zapada na nekrotyczne zapalenie jelit (NEC), co dla jednej czwartej z nich kończy się śmiercią.
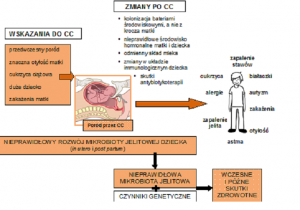
Różnorodne czynniki kształtujące mikrobiotę jelitową dziecka urodzonego przez CC podsumowano na Ryc. 2.
Skutki zdrowotne CC związane z nieprawidłową mikrobiotą jelitową
Dziecko rodzi się z niedojrzałym układem immunologicznym, a mikrobiota jelitowa jest niezbędna dla jego prawidłowego rozwoju. Bakterie jelitowe i ich metabolity (m.in. krótkołańcuchowe kwasy tłuszczowe; SCFA) regulują namnażanie, różnicowanie i aktywność limfocytów T. Sprawna regulacja tych komórek jest niezwykle ważna, gdyż brak równowagi w aktywności limfocytów Th1/Th2 prowadzi do rozwoju przewlekłych stanów zapalnych, schorzeń o podłożu autoimmunologicznym i alergii. Częstość tych chorób w populacji państw rozwiniętych wzrosła kilkukrotnie w ciągu ostatnich kilkudziesięciu lat, co wiąże się z czynnikami środowiskowymi: coraz częstszymi porodami przez CC i ograniczonym kontaktem z drobnoustrojami środowiskowymi w dzieciństwie (tzw. teoria nadmiernej higieny), co znacznie zubaża mikrobiotę jelitową i upośledza rozwój układu odpornościowego. Nieodpowiednio „wyuczony” układ immunologiczny zbyt silnie reaguje na niegroźne antygeny środowiskowe (np. z pokarmu) lub niszczy własne tkanki.
Dysbioza jelitowa po CC została do tej pory powiązana ze zwiększonym ryzykiem rozwoju następujących chorób: astmy, kataru alergicznego, alergii pokarmowych, egzemy/atopowego zapalenia skóry, cukrzycy typu 1, autoimmunologicznego zapalenia stawów, zapalnych chorób jelita (przewlekłego zapalenia jelita grubego i choroby Crohna), celiakii, otyłości, niedoborów immunologicznych, białaczki i autyzmu. Wymienione choroby obserwowane w późniejszym okresie życia można więc uważać za późne powikłania CC.
Wczesne powikłania związane z nieprawidłowym rozwojem mikrobioty jelitowej obserwowane po CC to groźne zakażenia komensalnymi grzybami z rodzaju Candida, bakteriami patogennymi, m.in. z rodzajów Klebsiella, Haemophilus, Clostridium, a także bakteriami opornymi na klasyczną antybiotykoterapię, np. metycylinoopornym Staphylococcus aureus (MRSA) nabywanym jako zakażenie szpitalne.
Wczesne i późne skutki zaburzeń mikrobioty jelitowej po CC przedstawiono na Ryc. 2.
Probiotyki/prebiotyki u matki i dziecka po CC
Okno czasowe, kiedy rozwija się mikrobiota jelitowa jest dość wąskie i obejmuje okres życia prenatalnego i pierwsze 3 lata życia postnatalnego. W tym czasie możliwe są różne interwencje u ciężarnej/matki karmiącej oraz dziecka, które mogą wpłynąć na rozwój mikrobioty jelitowej oseska, korygując w pewnym stopniu nieprawidłowości spowodowane porodem drogą CC. Najwcześniejszym sposobem profilaktyki zaburzeń mikrobioty u dziecka jest zadbanie o zdrowie jego matki, co w oczywisty sposób korzystnie wpłynie na stan jej własnej mikrobioty jelitowej, która jest przekazywana drogą krwi rozwijającemu się płodowi, a potem wraz z mlekiem noworodkowi/niemowlęciu. Matczyne bakterie jelitowe drogą krwi (niesione w leukocytach) mogą trafiać nie tylko do łożyska i płodu, ale też do gruczołu sutkowego i wraz z mlekiem matki do jelita dziecka.
W mleku ludzkim stwierdzono obecność bakterii z ponad 200 różnych gatunków. Bakterie w gruczole sutkowym pojawiają się w trzecim trymestrze ciąży, w tym samym czasie, kiedy zmienia się skład mikrobioty jelitowej i następuje jej większa translokacja do krążenia. Liczba bakterii jest więc największa w siarze, potem wolno spada podczas dalszej laktacji i szybko podczas inwolucji gruczołu sutkowego. Wszystkie te zmiany skoordynowane są z gospodarką hormonalną w organizmie kobiety. Warto pamiętać, że poza korzystnymi bakteriami mleko ludzkie zawiera cenne substancje sprzyjające wzrostowi symbiotycznych bakterii, w tym oligosacharydy, które nie są trawione przez enzymy jelitowe dziecka, ale są źródłem energii dla mikrobów jelitowych, a także substancje hamujące wzrost mikrobów patogennych. Dla prawidłowego rozwoju mikrobioty jelitowej noworodka, szczególnie urodzonego przez CC, ważne jest więc jak najwcześniejsze rozpoczęcie karmienia naturalnego przez matkę, która jest w dobrej kondycji zdrowotnej.
Zdrowie matki można modyfikować podając probiotyki (żywe drobnoustroje korzystnie wpływające na nasz organizm) i/lub substancje stymulujące ich wzrost, czyli prebiotyki, zarówno w żywności, jak i w postaci suplementów diety. Prebiotyki podawane matkom podczas ciąży i karmienia istotnie zwiększały liczbę Bifidobacterium sp. w jelicie kobiet, ale to bifidogenne działanie nie było widoczne u ich dzieci. Kilka testów klinicznych potwierdziło także korzystne działanie prebiotyków podawanych niemowlętom – obserwowano korzystny wpływ na skład i stabilizację mikrobioty jelitowej oraz modulację działania układu immunologicznego, co przekładało się na rzadsze występowanie infekcji jelitowych i biegunek oraz zakażeń dróg oddechowych, rzadszą potrzebę stosowania antybiotyków oraz mniejszą częstość egzemy/atopowego zapalenia skóry. Liczne są badania, w których oceniano skuteczność probiotyków w ogólnej grupie dzieci i dorosłych. Analiza testów klinicznych obejmujących prawie 47 tys. osób potwierdziła korzystny wpływ suplementacji probiotyków m.in. w profilaktyce biegunek, NEC, ostrych infekcji górnych dróg oddechowych, egzemy czy zaostrzeń objawów płucnych u dzieci z mukowiscydozą. Obserwowano też poprawę parametrów kardiometabolicznych i obniżenie wskaźników zapalenia u osób dorosłych z cukrzycą typu 2. Zbiorcze zestawienie wyników wybranych badań pediatrycznych zawiera Tab. 1.
Tab. 1. Zestawienie wybranych metaanaliz pediatrycznych badań klinicznych wykazujących skuteczność profilaktycznego/leczniczego stosowania probiotyków z różnych wskazań;
|
Cel postępowania (profilaktyka lub leczenie) |
Liczba badań/ łączna liczba uczestników |
Wynik badania |
|
| Przewlekła biegunka wywołana zakażeniem Clostridium difficile |
39/9955 |
Probiotyki były bezpieczne i skuteczne w profilaktyce zakażeń (spadek liczby infekcji o 70%) |
|
|
NEC u wcześniaków |
17/5338 |
Podawane enteralnie probiotyki były skuteczne w profilaktyce NEC (spadek częstości występowania o 57%) i śmiertelności z innych przyczyn (spadek o 35%) | |
| Ostre zakażenia górnych dróg oddechowych u dzieci, dorosłych i osób starszych |
12/3720 |
Podawane profilaktycznie probiotyki zmniejszały liczbę osób z objawami infekcji, skracały czas trwania objawów i czas absencji w szkole oraz użycie antybiotyków |
|
| Egzema u niemowląt i dzieci |
16/2797 |
Probiotyki podawane przez pierwsze kilka lat życia dziecka zmniejszały częstość występowania egzemy o 26% |
|
| Biegunka rotawirusowa u niemowląt i dzieci |
14/1149 |
Probiotyki podawane leczniczo skracały czas trwania biegunki |
|
| Zaostrzenie objawów płucnych u dzieci z mukowiscydozą |
9/275 |
Redukcja współczynnika zaostrzenia objawów o 75% |
|
Skuteczność probiotyków zwiększa się łącząc je w jednym preparacie z substancją prebiotyczną (np. GOS, FOS, inuliną, błonnikiem), która ma ułatwić wzrost i aktywność metaboliczną danego probiotyku. Takie połączenie jest określane mianem synbiotyku.
Komitet ds. Żywienia Europejskiego Towarzystwa Gastroenterologii, Hepatologii i Żywienia Dzieci (ang. European Society for Pediatric Gastroenterology, Hepatology and Nutrition; ESPGHAN) wydał w 2011 roku wytyczne odnośnie stosowania preparatów mlekozastępczych dla niemowląt wzbogaconych w probiotyki i/lub prebiotyki. Po przeanalizowaniu licznych danych naukowych stwierdzono, że preparaty te są bezpieczne dla zdrowych niemowląt i nie powodują niepożądanych działań. Jednocześnie podkreślono, że obecnie zgromadzone dane są niewystarczające by rekomendować ich rutynowe użycie.
autor: Jolanta Artym, Zakład Terapii Doświadczalnej, Instytut Immunologii i Terapii Doświadczalnej Polskiej Akademii Nauk we Wrocławiu

